AG Ellenrieder
Transkriptionelle metabolische Reprogrammierung bei Pankreas- und Lebererkrankungen

Forschungsschwerpunkte
Pankreas
Pankreaskarzinom
Pro Jahr erkranken mehr als 19.000 Menschen an einem Pankreaskarzinom. Nichtsdestotrotz versterben mehr als 75% der Patienten innerhalb des ersten Jahres nach Diagnosestellung an dieser Erkrankung. Im Gegensatz zu anderen Tumorentitäten, wird dem Pankreaskarzinom trotz intensiver Forschung und Bemühungen ein Anstieg an Karzinom-bedingten Todesfällen vorhergesagt. Die schlechte Prognose von Pankreaskarzinomen liegt zum einen an der meist späten Diagnose aber auch an schlechtem Therapieansprechen dieser Krebsart. Nur für etwa 10-20% der Patienten kommt eine kurative Resektion in Frage, da das Karzinom in einem lokalisierten Tumorstadium diagnostiziert wurde. Für die übrigen Patienten bleiben meist nur palliative Therapiemöglichkeiten, wie chemotherapeutische Behandlungen, die allerdings meist nur einen geringen Einfluss auf den Krankheitsverlauf haben.
Die Bedeutung von NFATc1 und GSK3β in der Behandlung des Pankreaskarzinoms
Auf Grund der wenigen Therapieoptionen, bei gleichzeitig hoher Tumorheterogenität, hat sich die Forschung der letzten Jahre auf die Identifikation transkriptioneller Subtypen fokussiert.
In Vorarbeiten für und im Rahmen der KFO 5002 ist es uns gelungen, eine Untergruppe von Bauchspeicheldrüsenkrebs zu identifizieren, die durch eine Anhäufung der GSK3β-Kinase im Zellkern von Bauchspeicheldrüsenkrebszellen und eine hohe Koexpression des Transkriptionsfaktors NFATc1 gekennzeichnet ist.
Über die Stabilisierung und Aktivierung von NFATc1 vermittelt GSK3β wichtige Funktionen, die mit der Tumorprogression und der Resistenz gegen Chemotherapie, insbesondere gegen Cisplatin, zusammenhängen. Die Aktivierung der GSK3β-NFAT-Signalkaskade erfolgt bei der Anpassung an Entzündungen, bei der Aktivierung onkogener Signalwege (z. B. Kras-Mutation) oder bei der Induktion von zellulärem Stress als Reaktion auf Veränderungen in der Mikroumgebung des Tumors. In diesem Zusammenhang steuert NFATc1 die Expression wichtiger Gensignaturen, die an der Regulierung lebenswichtiger Funktionen von Tumorzellen wie Überleben, Wachstum und Plastizität beteiligt sind.
Wir konnten zeigen, dass NFATc1 die Expression von BRCA1, BRCA2 und anderen DNA-Reparaturgenen stimuliert, was Auswirkungen auf das homologe Rekombinationssystem hat. Die Hemmung der GSK3β-Kinase oder der genetische Verlust von NFATc1 verhindert die Cisplatin-induzierte BRCA-Expression und die DNA-Schadensreparatur, wodurch die Zellen wieder für eine Cisplatin-Behandlung sensibilisiert werden.
Im Folgenden wollen wir die Rolle der Tumormikroumgebung bei der NFATc1-regulierten Zellanpassung weiter analysieren. Insbesondere wollen wir herausfinden, wie sich Veränderungen von Sauerstoff und Nährstoffen in der Tumormikroumgebung auf die NFATc1-regulierte Transkription in Tumorzellen auswirken und wie sich dies auf die Entwicklung von Resistenzen auswirkt.
Untersuchung der Rolle von HIF1α und NFATc1 bei der Hypoxie-induzierten metabolischen Reprogrammierung und Resistenzmechanismen im Pankreaskarzinom
Insbesondere beim Pankreaskarzinom sind Sauerstoffmangel und eine veränderte Versorgung mit Glukose und Glutamin charakteristisch.
In Vorarbeiten konnten wir zeigen, dass Hypoxie den Stoffwechsel von Tumorzellen über die Aktivierung von HIF1α beeinflusst und dass der Verlust von NFATc1 die Hypoxie-induzierte Expression von Hypoxia-inducible factor-1-alpha (HIF1α) verringert. Weiterhin ist die Hypoxie als ein wichtiger Treiber der Glykolyse im PDAC bekannt und an der Vermittlung der Resistenz beteiligt.
Wir vermuten, dass NFATc1 und HIF-Transkriptionsfaktoren gemeinsam die Hypoxie-induzierte Genregulation in resistenten Tumorzellen steuern und die NFATc1-vermittelte Genregulation der Schlüssel für die HIF-induzierte metabolische Reprogrammierung als Reaktion auf Hypoxie ist.
Aufbauend darauf werden wir die Mechanismen der NFATc1-vermittelten Stabilität von HIF1α charakterisieren. Zu diesem Zweck werden wir die NFATc1-abhängige Aktivität von sauerstoffabhängigen HIF-abbauenden Enzymen untersuchen und die Funktion und Regulierung der Prolyl-4-Hydroxylase-Domäne (PHD)-Proteinfamilie in cisplatinempfindlichen und -resistenten Zellen sowie als Reaktion auf Glutaminmangel und/oder Hypoxie bewerten.


Akute Pankreatitis
Die akute Pankreatitis ist eine primär sterile (nicht-infektiöse) Erkrankung des Pankreas. Schwere Verläufe der akuten Pankreatitis sind mit einem hohem Mortalitäts- und Morbiditätsrisiko verbunden, die auf die Entwicklung von Pankreas- und extrapankreatischen Nekrosen, deren anschließende Infektion und ein folgendes Multisystem-Organversagen zurückzuführen sind. Die Behandlung der akuten Pankreatitis ist aufgrund des begrenzten Verständnisses der Pathogenese, der Multikausalität der Krankheit und der wenigen wirksamen Behandlungsmodalitäten begrenzt. Dies untermauert die Notwendigkeit weiterer Erforschung der zu Grunde liegenden Pathophysiologie.
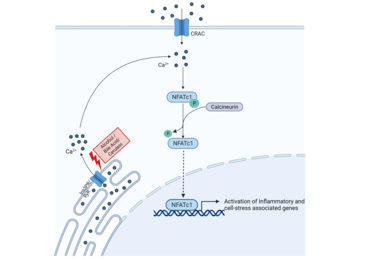
NFATc1 und CRAC-Kanal vermittelte Signalwege in akuter Pankreatitis
In der aktuellen Forschung hat sich eine entscheidende Bedeutung der Calcium-Homöostase in Azinuszellen herauskristallisiert, insbesondere im Hinblick auf sogenannte Calcium Release-Activated Calcium (CRAC)-Kanäle und chronischen Zellstress. Der Transkriptionsfaktor NFATc1 ist in Caerulin-basierten in vivo und in vitro Modellen signifikant exprimiert und aktiviert. Dies korreliert mit einer Hochregulierung von Zellstress-Proteinen, Veränderungen in der Calcium-Homöostase und der Induktion wichtiger inflammatorischer Zytokine.
Im Mittelpunkt unserer Forschung steht die Aufklärung des Zusammenhanges zwischen NFATc1 Expression und der Regulierung des Calcium Signalweges. Die gewonnenen Erkenntnisse tragen dazu bei, das Verständnis der zugrunde liegenden molekularen Mechanismen der Erkrankung zu vertiefen und eröffnen neue Perspektiven für innovative Therapieansätze.
Leber
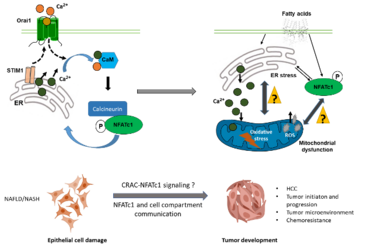
Calcium Release Activated Channel (CRAC) - NFATc1-Signalübertragung bei nichtalkoholischer Steatohepatitis (NASH) und hepatozellulärem Karzinom (HCC)
Die Inzidenz der nichtalkoholischen Fettlebererkrankung (NAFLD) nimmt in den westlichen Ländern weiterhin rapide zu, und bei einer beträchtlichen Anzahl von NAFLD-Patienten besteht das Risiko, dass sie eine Leberzirrhose und ein hepatozelluläres Karzinom (HCC) entwickeln. Ein besseres Verständnis der Prozesse, die zur Entstehung und zum Fortschreiten von NASH und der anschließenden Krebsentwicklung führen, ist für die Entwicklung ausreichender Präventionsstrategien unerlässlich.
Einer der wichtigsten Forschungsschwerpunkte unserer Gruppe ist die Untersuchung der Veränderungen in der Kalziumhomöostase und der durch Kalzium regulierten nachgeschalteten Signalübertragung bei der Entwicklung von NASH und NASH-bedingtem HCC. In einer früheren Studie haben wir eine wichtige funktionelle Rolle des Ca2+-abhängigen NFATc1-Signal- und Transkriptionswegs bei der Vermittlung chronischer ER-Stressreaktionen und der anschließenden Manifestation von NASH nachgewiesen.
Unser Forschungsschwerpunkt ist die Charakterisierung der Rolle und des therapeutischen Potenzials des durch ER-Stress induzierten Ca2+-Eintritts über Ca2+-release-aktivierte Ca2+-Kanäle (CRAC-Kanäle) und der anschließenden NFATc1-Aktivierung bei der Entwicklung von HCC, insbesondere durch die transkriptionelle Regulierung von Gensignaturen, die an ER-Stress-Reaktionen, dem Zellüberleben und der Bildung einer immunsuppressiven Mikroumgebung beteiligt sind.
Konkrete Ziele:
1. Charakterisierung des onkogenen Potenzials der CRAC-vermittelten NFATc1-Signalaktivierung bei NASH-assoziiertem HCC
2. Bestimmung der funktionellen und transkriptionellen Konsequenzen der CRAC-NFATc1-Signalübertragung in NAFLD-NASH und HCC
3. Untersuchung des therapeutischen und präventiven Potenzials der Inaktivierung des CRAC-NFATc1-Signalwegs bei NASH-bedingtem HCC


Team

Kontaktinformationen
- Telefon: +49 551 3962301
- E-Mail-Adresse: volker.ellenrieder(at)med.uni-goettingen.de
Sekretariat
- E-Mail-Adresse: gastroonko.sekretariat(at)med.uni-goettingen.de
Direktor der Klinik für Gastroenterologie, gastrointestinale Onkologie und Endokrinologie
Arbeitsgruppenleiter

Assistenzärztin
Wissenschaftliche Mitarbeiterin - AG Ellenrieder
Schwerpunkt Onkologie
Bei Interesse an Laborrotationen, Bachelor- oder Master- sowie Doktorarbeiten Anfrage unter: Tel: 0551 3962301 oder volker.ellenrieder(at)med.uni-goettingen.de und umair.latif(at)med.uni-goettingen.de
Förderung
Publikationen
Auszeichnungen der Gruppenmitglieder
- Arbeitsgemeinschaft Internistische Onkologie, Kongressstipendium für den ESMO-Kongress, 2024, Dr. Sabrina Sulzer
- Deutscher Pankreasclub, Posterpreis, 2024, Anna Weber
- Deutscher Pankreasclub, Posterpreis mit Reisestipendium, 2024, Aiko Bockelmann
- Deutsche Krebshilfe, Stipendium für Fachkreise für den Deutschen Krebskongress, 2024, Dr. Sabrina Sulzer
- Best Abstract Preis der Session "Burning questions in acute pancreatitis", UEG-Week 2023, Anna Weber
- Stipendium Master Class: Chronische Pankreatitis der United European Gastroenterology (UEG), 2023, Dr. Sabrina Sulzer
- Gerok-Stipendium der Klinischen Forschungsgruppe 5002 „Charakterisierung und Targeting der Genomdynamik für eine Subtyp-spezifische Therapie des Pankreaskarzinoms“, 2023, Dr. Sabrina Sulzer
- "Very important publication" Award (Gö-VIP) für die Gut Studie: NFATc1 signaling drives chronic ER stress responses to promote NAFLD progression, 2022, Dr. Umair Latif
- Stipendium der European Association for the Study of Liver (EASL) für den internationalen Leberkongress, 2022, Dr. Umair Latif
- Otto Porges-Abstractpreis der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS), 2021, Dr. Umair Latif
- Young Investigator Award der European Association for the Study of Liver (EASL) für den NAFLD-Gipfel in Sevilla, 2019, Dr. Umair Latif
- Best Poster Award, 4. NASH Meeting in Paris, 2018, Dr. Umair Latif
Kooperationen
- AG Heßmann, Universitätsmedizin Göttingen
- AG Neeße, Universitätsmedizin Göttingen
- AG Singh, Universitätsmedizin Göttingen
- Prof. Matthias Dobbelstein, Universitätsmedizin Göttingen
- Prof. Phillip Ströbel and Hanibal Bohnenberger, Universitätsmedizin Göttingen
- Prof. Jens Siveke, Westdeutsches Tumorzentrum, Essen
- Prof. Irene Esposito, Universitätsklinikum Düsseldorf
- Prof. Steven Johnsen, Mayo Clinic Rochester, USA
- Dr. Gwen Lomberk, Mayo Clinic, Rochester, USA
- Prof. Raul Urrutia, Mayo Clinic, Rochester, USA
- Dr. Oliver Hahn, Universitätsmedizin Göttingen